組織について
育種研究センター(Research Center for Aquatic Breeding)
育種研究センターは、水産生物の育種のための研究開発、系統の作出および育種の実用化に必要な基盤技術開発や調査に関する業務を行っています。
センターの構成
育種研究センター長 照屋 和久 ゲノム育種グループ(Genomics Breeding Group) 系統開発グループ(Strain Development Research Group) 育種基盤グループ(Breeding Technology Development Group)
ゲノム育種グループ(Genomics Breeding Group)
ゲノム育種グループは、基本的な育種技術や形質評価技術及び系統の作出と安全性評価等に関する研究開発を行っています。
主にブリ、ヒラメ、トラフグなどの海産魚を対象に、病気に強い、成長が速いなどといった優良な形質の評価法の開発、それらの形質を持つ家系を選抜育種するための指標となる遺伝子マーカーの開発、選抜に頼らない人為的な変異導入法などの開発に取り組んでいます。また、主にサケ・マス類、コイなどの淡水魚を対象に、遺伝子組換え魚や外来種による遺伝資源のかく乱の防止や天然資源の生物多様性の保全の観点から、遺伝子組換え魚類の検出や生物多様性への影響評価のための研究開発に取り組んでいます。
 |
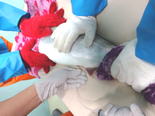
 レンサ球菌抵抗性ヒラメ家系の民間生産現場での実用化試験 |
系統開発グループ(Strain Development Research Group)
系統開発グループは、DNAマーカー開発等に必要な解析家系の作出、選抜交配等による系統化やその優良性評価などにかかる研究開発を行っています。
主にブリ類などの海産魚を対象に、計画的な成熟促進産卵誘発技術、家系作出のための1:1交配および人工授精技術の開発、人工交配により得た種苗の形態や生残、成長などの特性の評価および健全な種苗を育成するための飼育技術の開発などに取り組んでいます。
 |
 |
| ブリ選抜親魚の成熟調査 | 優良系統開発のための解析用家系の作出 |
育種基盤グループ(Breeding Technology Development Group)
育種基盤グループは、不妊化技術や成熟制御技術等に関する研究開発を行っています。
主に海産魚を対象に、育種した魚類が万一野外へ逃亡した場合にそこで繁殖してしまうことの防止や、育種した魚類に関する権利の保護などのため、不妊化技術の開発に取り組んでいます。また、海産魚を対象に、育種のために必要となる成熟制御技術や配偶子の質の評価技術の開発などに取り組んでいます。また、餌料用海産微細藻類の保存事業では、国内での研究・教育用として要望された株を配布できる体制を整えています。同時に、これらの特性解明を通じ、遺伝資源の有効利用に貢献します。
 |
 |
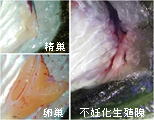
| 海産魚の不妊化手法の開発(写真はヒラメの例) | 水産用餌料として有用な海産微細藻類の保存事業 |
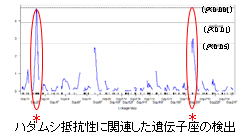
 ↑上:ブリの体表面に寄生したハダムシ →右:DNA マーカーによるハダムシ抵抗性ブリの育種 |
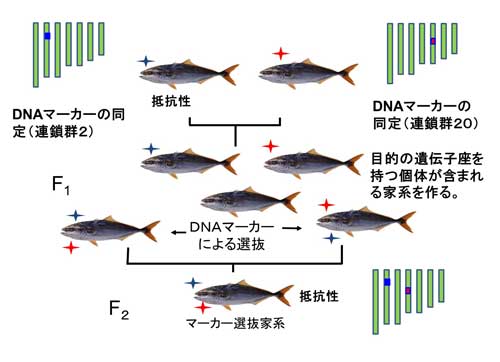 図をクリックすると拡大 |
主な研究課題と研究期間
- 水研機構交付金課題 遺伝子資源の収集・評価・管理ならびに利用技術の開発(ジーンバンク事業) (2016-2020)
- 水研機構交付金課題 海産有用魚類の効率的保存・復元技術の開発(2016-2020)
- 水研機構交付金課題 ブリ優良人工種苗周年供給システムの構築 (2018-2020)
- 水研機構交付金プロ 細菌性疾病抵抗性ヒラメの実用化実証・対策研究(2018-2019)
- 農林水産技術会議 革新的技術開発・緊急展開事業「水産物の国際競争に打ち勝つ横断的育種技術と新発想飼料の開発」 のうち、「高成長ブリ類家系を天然魚から短期間で作出可能な新たな育種技術開発」および「耐病性や真珠品質にもとづくアコヤガイ選抜技術と育種素材の開発」(2016-2020)
- 農林水産技術会議 光周期を利用して成熟を抑制し生産性を飛躍させる魚介類養殖手法の開発 (2019-2022)
- 水産庁委託事業 養殖業の成長産業化のための優良系統の開発事業(養殖業成長産業化技術開発事業) (2019-)
- 科研費 二枚貝におけるレチノイン酸の卵成熟誘起機構の解明(2019-2021)
「水産育種研究戦略 -水産育種研究の今後の進め方について-」 平成25 年3 月
http://www.fra.affrc.go.jp/publications/manuals/Strategy_of_breeding_research.pdf
発表論文
- Higuchi, K., Kazeto, Y., Ozaki, Y., Yamaguchi, T., Shimada, Y., Ina, Y., Soma, S., Sakakura, Y., Goto, R., Matsubara, T., Nishiki, I., Iwasaki, Y., Yasuike, M., Nakamura, Y., Matsuura, A., Masuma, S., Sakuma, T., Yamamoto, T., Masaoka, T., Kobayashi, T., Fujiwara, A., Gen, K., 2019. Targeted mutagenesis of the ryanodine receptor by Platinum TALENs causes slow swimming behaviour in Pacific bluefin tuna (Thunnus orientalis). Sci. Rep. In press.
- Nyuji, M., Yamamoto, I., Hamada, K., Kazeto, Y., Okuzawa, K., 2019. Effect of GnRHa on plasma levels of Fsh and Lh in the female greater amberjack Seriola dumerili. J. Fish Biol. In press.
- Suzuki, H., Kazeto, Y., Gen, K., Ozaki, Y., 2019. Functional analysis of recombinant single-chain Japanese eel Fsh and Lh produced in FreeStyle 293-F cell lines: Binding specificities to their receptors and differential efficacy on testicular steroidogenesis. Gen Comp Endocrinol. In press.
- Ozaki, Y., Damsteegt, EL., Setiawan, AN., Miura, T., Lokman, PM., 2019. Expressional regulation of gonadotropin receptor genes and androgen receptor genes in the eel testis. Gen Comp Endocrinol. 280, 123-133.
- Kazeto, Y., Tanaka, T., Suzuki, H., Ozaki, Y., Fukada, H., Gen, K., 2019. Development and validation of enzyme‑linked immunosorbent assays specific for follicle‑stimulating hormone and luteinizing hormone in Japanese eel. Fish. Sci. 85, 829–837.
- Awaji, M., Matsumoto, T., Ojima, D., Inoue, S., Suzuki, M., Kanematsu, M., 2018.Oocyte maturation and active motility of spermatozoa are triggered by retinoic acid in pen shell Atrina pectinate. Fish. Sci., 84, 535-551
- Nyuji, M., Hamada, K., Kazeto, Y., Mekuchi, M., Gen, K., Soyano, K., Okuzawa, K., 2018. Photoperiodic regulation of plasma gonadotropin levels in previtellogenic greater amberjack (Seriola dumerili). Gen Comp Endocrinol. 269, 149-155.
- 正岡哲治,名古屋博之,岡本裕之,荒木和男,藤原篤志,小林敬典 (2018)屋外大型飼育池におけるコイとフナ類の自然交雑の確認.DNA多型 26, 25-29
- Masaoka T, Okamoto H, Araki K, Nagoya H, Fujiwara A, Kobayashi T (2018) Distinction between non-native and Japanese native cyprinid fishes based on mitochondrial 16S ribosomal RNA gene regions. DNA Testing 10, 31-41
- 正岡哲治,名古屋博之,岡本裕之,荒木和男 (2018) X線照射による遺伝子組換えアマゴの不妊化.水産育種 48,117-123
- 岡本裕之、黒田拓男、澤田知希、白木谷卓哉、金田康見、荒川純平、尾崎照遵、石川卓、宮本淳司、岡村康弘 (2017) キンギョを用いた突然変異誘発. 水産育種 47, 49-54
- 川瀬純也, 青木純哉, 浜田和久, 尾崎 照遵, 荒木 和男 (2018) Identification of Sex-associated SNPs of greater amberjack (Seriola dumerili). Journal of Genomics 6, 53-62
- Masaoka T, Okamoto H, Araki K, Nagoya H, Fujiwara A, Kobayashi T (2017) Distinction of unknown Pinctada species based on 28S and 16S ribosomal RNA gene regions and IGS regions of nuclear ribosomal RNA genes. DNA Testing 9, 23-34
- 正岡哲治,名古屋博之,岡本裕之,荒木和男,藤原篤志,小林敬典 (2017) 産卵を誘発する人為的環境におけるコイとフナ類の自然交雑の確認.DNA多型 25, 11-15
- 中本正俊, 竹内祐輔, 秋田 一樹, 熊谷諒, 鈴木淳平, 小山喬, 野田勉, 吉田一範, 尾崎照遵, 荒木和男, 坂本崇 (2017) A novel C-type lectin gene is a strong candidate gene for Benedenia disease resistance in Japanese yellowtail, Seriola quinqueradiata. Developmental & Comparative Immunology 2017, 361-369
- 正岡哲治,名古屋博之,岡本裕之,荒木和男,藤原篤志,小林敬典 (2016) PCRを利用したコイとフナ類の雑種判別.DNA多型 24, 23-26
- 嶋田幸典,石川 卓,名古屋博之,薄浩則,堀田卓朗,吉田一範,藤浪祐一郎,岡本裕之 (2016) ブリ卵の小型容器を用いた高塩分孵化管理方法の開発. Nippon Suisan Gakkaishi 82, 601-607
研究トピックス
- 卵を作る遺伝子の働きを抑えて外来魚を駆除する方法を考案(49号、2016年12月)
- タイラギ種苗生産を支えるエサ(47号、2016年7月)
- 養殖品種のDNA 鑑定に使えるマーカーを簡単に見つける方法を開発(36号、2013年9月)
- ブリの表皮に寄生するハダムシから身を守る遺伝子の存在を初めて証明(36号、2013年9月)
- 突然変異を利用して新たな養殖魚をつくる技術(35号、2013年7月)
- ぶり類育種、トラフグ育種(35号、2013年7月)
- 真珠100 年の謎をついに解明(35号、2013年7月)
- ハプト藻類イソクリシス・タヒチ株(34号、2013年3月)
- ハダムシ寄生症への抵抗性のある家系を作る(33号、2012年12月)
- 光拡散機能付きLEDで微細藻類保存培養(32号、2012年9月)
- ジーンバンク配布株の紹介-微細珪藻フェオダクチラム(32号、2012年9月)
- 白化出現頻度が低いヒラメ家系を選ぶ(29号、2012年1月)
- 水産生物遺伝資源保存事業(ジーンバンク事業)(29号、2012年1月)
- 遺伝子組換え魚の流通を監視する(26号、2011年3月)
 日本の養殖の成長産業化のカギを握る育種研究 I,II (8号、2019年3月)
日本の養殖の成長産業化のカギを握る育種研究 I,II (8号、2019年3月)
 ゲノム編集の概要(8号、2019年3月)
ゲノム編集の概要(8号、2019年3月)
 ゲノム編集で外来魚を駆除する技術開発(8号、2019年3月)
ゲノム編集で外来魚を駆除する技術開発(8号、2019年3月)
 ブリにおけるハダムシ寄生抵抗性遺伝子領域の特定とDNAマーカーアシスト選抜法の成功(5号、2015年2月)
ブリにおけるハダムシ寄生抵抗性遺伝子領域の特定とDNAマーカーアシスト選抜法の成功(5号、2015年2月)
 紫外線を利用した不妊化技術の開発ー育種研究における不妊化技術の役割ー(5号、2015年2月)
紫外線を利用した不妊化技術の開発ー育種研究における不妊化技術の役割ー(5号、2015年2月)
 育種や作出品種のための凍結保存技術の開発ークエの卵でブリの凍結精子を評価-(5号、2015年2月)
育種や作出品種のための凍結保存技術の開発ークエの卵でブリの凍結精子を評価-(5号、2015年2月)
![]() FRANEWS(本部HP)に掲載された関連記事の再録です。
FRANEWS(本部HP)に掲載された関連記事の再録です。
![]() 増養殖研究レターに掲載された記事の再録です(8号の内容はみなと新聞「養殖研究フロントライン」にも掲載されました)。
増養殖研究レターに掲載された記事の再録です(8号の内容はみなと新聞「養殖研究フロントライン」にも掲載されました)。