 |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
پ@2.پ@‘ھ’茴— |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
پ@
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
3.پ@‘ھ’èڈ€”ُ
پ@پ@پ@3-1.پ@ژژ–ٍ’²گ® پF ڈ\•ھ‚ةچ¬کa‚·‚éپB
3-2.پ@Œں‘ج’²گ®پE•ھ’چ پ@ƒRƒCŒŒگ´‚ًٹَژك‰t‚إ500”{‚ةٹَژك‚µپAڈ\•ھ‚ةچ¬چ‡‚·‚éپB پ@‡@ Œں‘ج‚جƒRƒCŒŒگ´‚ً500”{ٹَژك‚µپAڈ\•ھ‚ةچ¬چ‡‚·‚éپB پ@پ@پ@پ@پ@ƒvƒŒپ[ƒg‚جƒŒƒCƒAƒEƒg—ل پi1Œں‘ج 3ڈd‘ھ’è—لپj 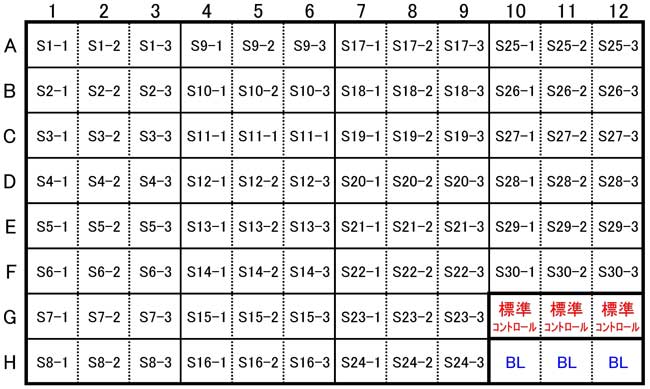 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
4.پ@‘ھ’è•û–@
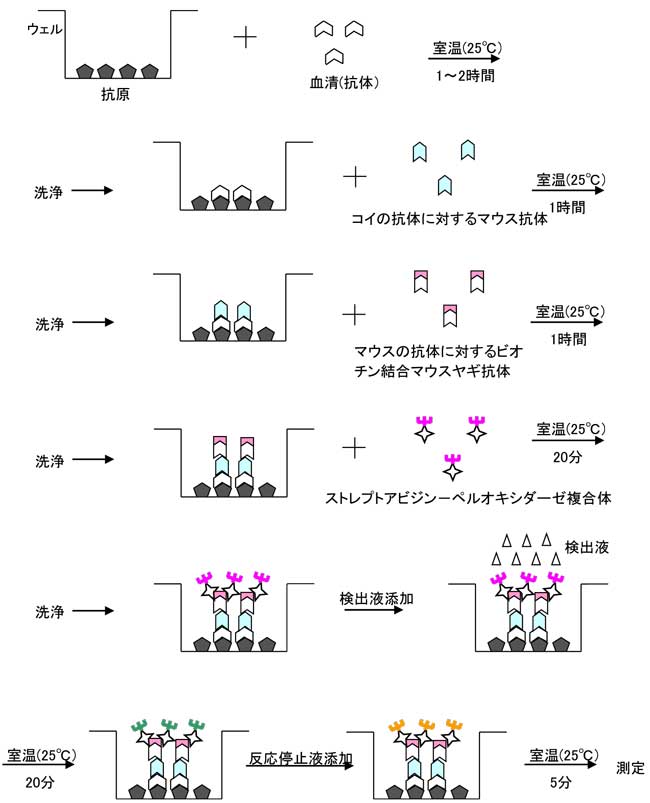
پ@‚±‚جƒvƒچƒgƒRپ[ƒ‹‚ح‘S96ƒEƒFƒ‹‚ًژg—p‚µ‚½ڈêچ‡‚ج•û–@پB پ ƒXƒeƒbƒv 1-1پF Œإ‘ٹ‰»ƒvƒŒپ[ƒg‚ًژ؛‰·‚ة–ك‚· پ ƒXƒeƒbƒv 1-2پF ژژ–ٍ—n‰t‚جڈ€”ُ‚¨‚و‚رŒں‘جٹَژك پ– ‘€چى‘O‚ةپAƒvƒŒپ[ƒg‚ھƒvƒŒپ[ƒgƒٹپ[ƒ_پ[‚ةƒZƒbƒg‚إ‚«‚邱‚ئ‚ًٹm”F‚·‚éپB پ ƒXƒeƒbƒv 2پF Œإ‘ٹ‰»ƒvƒŒپ[ƒg‚جگôڈٍ پ@ژ؛‰·‚ة–ك‚µ‚½Œإ‘ٹ‰»ƒvƒŒپ[ƒg‚ًپC‚ ‚ç‚©‚¶‚ك’²گ»‚µ‚ؤ‚¨‚¢‚½گôڈٍ‰t‚إ3‰ٌگôڈٍ‚µپCگôڈٍŒم‚حٹ®‘S‚ة‰t‚ًژو‚èڈœ‚پB پ@ƒٹƒUپ[ƒoپ[‚ةگôڈٍ‰t‚ً“ü‚êپAƒ}ƒ‹ƒ`ƒ`ƒƒƒ“ƒlƒ‹ƒsƒyƒbƒg‚إ‚·‚ׂؤ‚جƒEƒFƒ‹‚ة240uLپi120uLx2‰ٌپj‚¸‚آ“ü‚ê‚éپB‚»‚ج‚ـ‚ـ1پ`2•ھگأ’u‚µپAƒvƒŒپ[ƒg‚ً— •ش‚µ‚ة‚µ‚ؤ‰t‚ًژج‚ؤ‚éپB‚±‚ج‘€چى‚ً3‰ٌŒJ‚è•ش‚·پB * ELISAƒvƒŒپ[ƒgƒEƒHƒbƒVƒƒپ[‚ًژg—p‚·‚éڈêچ‡‚ح‚»‚ꂼ‚ê‚ج‹@ٹB‚جƒ}ƒjƒ…ƒAƒ‹‚ًژQڈئ‚·‚邱‚ئپB پ@گôڈٍ‚ھڈI‚ي‚ء‚½ƒvƒŒپ[ƒg‚حپAچإŒم‚ة— •ش‚µ‚ة‚µ‚ؤƒyپ[ƒpپ[ƒ^ƒIƒ‹‚ب‚ا‚جڈم‚ة‚½‚½‚«‚آ‚¯پAƒyپ[ƒpپ[‚ةگ…‹C‚ھ‚آ‚©‚ب‚‚ب‚éˆت‚ـ‚إ‰t‚ًگط‚éپB پ@’چ ) پFگôڈٍ‰t‚ھژc‚ء‚ؤ‚¢‚é‚ئ‘ھ’è’l‚ة‰e‹؟‚ً—^‚¦‚é‚ج‚إپAŒں‘ج‚ً“ü‚ê‚é‘O‚جƒvƒŒپ[ƒg‚حٹ®‘S‚ة‰t‚ًڈœ‚‚±‚ئ‚ھ‘هگطپB پ ƒXƒeƒbƒv 3پF چRŒ´‚ئŒں‘ج‚ج”½‰ پ@500”{ٹَژك‚µ‚½Œں‘ج‚ً1ƒEƒFƒ‹50uL‚¸‚آ“ü‚ê‚éپB
پ@’چ ) پF Œں‘جپiƒŒپ[ƒ“پj‚²‚ئ‚ة•K‚¸ƒ`ƒbƒv‚ًژو‚è‘ض‚¦پAˆظ‚ب‚éŒں‘ج‚ھŒˆ‚µ‚ؤچ¬‚´‚ç‚ب‚¢‚و‚¤‚ة‚·‚éپB
پ@”½‰‰t‚ًژج‚ؤپAƒXƒeƒbƒv 2. ‚ئ“¯—l‚ة3‰ٌگôڈٍ‚·‚éپB پ ƒXƒeƒbƒv 5پF Sol. 1(چRƒRƒCچR‘جپj ‚ئ‚ج”½‰ پ@ƒٹƒUپ[ƒoپ[‚ة’²گ®‚µ‚ؤ‚¨‚¢‚½Sol. 1 ‚ج‰t‚ً“ü‚êپA‘S‚ؤ‚جƒEƒFƒ‹‚ة50uL‚¸‚آ•ھ’چ‚·‚éپB پ ƒXƒeƒbƒv 6پF گôڈٍ پ@”½‰‰t‚ًژج‚ؤپAƒXƒeƒbƒv 2. ‚ئ“¯—l‚ة3‰ٌگôڈٍ‚·‚éپB پ ƒXƒeƒbƒv 7پF Sol. 2(ƒrƒIƒ`ƒ“‰»چR‘جپj ‚ئ‚ج”½‰ پ@ƒٹƒUپ[ƒoپ[‚ةپC’²گ®‚µ‚ؤ‚¨‚¢‚½Sol. 2 ‚ج‰t‚ً“ü‚êپA‘S‚ؤ‚جƒEƒFƒ‹‚ة50uL‚¸‚آ“ü‚ê‚éپB
پ ƒXƒeƒbƒv 8پF گôڈٍ پ@”½‰‰t‚ًژج‚ؤپAƒXƒeƒbƒv 2. ‚ئ“¯—l‚ة3‰ٌگôڈٍ‚·‚éپB پ ƒXƒeƒbƒv 9پF Sol. 3(ƒyƒ‹ƒIƒLƒVƒ_پ[ƒ[•Wژ¯•¨پj ‚ئ‚ج”½‰ پ@ƒٹƒUپ[ƒoپ[‚ةپC’²گ®‚µ‚ؤ‚¨‚¢‚½Sol. 3 ‚ج‰t‚ً“ü‚êپA‘S‚ؤ‚جƒEƒFƒ‹‚ة50uL‚¸‚آ“ü‚ê‚éپB
پ ƒXƒeƒbƒv 10پF گôڈٍ پ@”½‰‰t‚ًژج‚ؤپAƒXƒeƒbƒv 2. ‚ئ“¯—l‚ة4‰ٌگôڈٍ‚·‚éپB پ ƒXƒeƒbƒv 11پF Œںڈo‰t ‚ئ‚ج”½‰ پ@ƒٹƒUپ[ƒoپ[‚ةŒںڈo‰t‚ً“ü‚êپA‘S‚ؤ‚جƒEƒFƒ‹‚ة100uL‚¸‚آ•ھ’چ‚·‚éپBƒAƒ‹ƒ~
پ@’چ پj پF—zگ«‚جڈêچ‡پAگآ‚”گF‚·‚éپB پ ƒXƒeƒbƒv 12پF ”½‰’âژ~ پ@ƒٹƒUپ[ƒoپ[‚ة”½‰’âژ~‰t‚ً“ü‚êپAŒںڈo‰t‚حژج‚ؤ‚ب‚¢‚ـ‚ـ‘S‚ؤ‚جƒEƒFƒ‹‚ة50uL‚¸‚آ“ٹ“ü‚µپA”½‰‚ً’âژ~‚³‚¹‚éپB‚±‚جژپA”½‰‰t‚ھکa‚³‚ê‚é‚و‚¤‚ةڈ‚µ‹‚ك‚ة•ھ’چ‚·‚éپB پ@’چ ) پFگآ‚¢”گF‚ھ‰©گF‚ة•د‰»‚·‚éپB پ ƒXƒeƒbƒv 13پF ‘ھ’è پ@”½‰’âژ~‰t‚ً“ü‚ê‚ؤ‚©‚ç5•ھŒمپA‚·‚®‚ةƒvƒŒپ[ƒgƒٹپ[ƒ_پ[‚إ450nm‚ج‹zŒُ“x‚ً‘ھ’è‚·‚éپB پ@’چ پj پF”½‰’âژ~ŒمپA‘ھ’è‚ـ‚إ‚ةژٹش‚ھŒo‚آ‚ئ‹zŒُ“x‚ھ•د‰»‚µ‚ؤ‚«‚ـ‚·پB
پ ƒXƒeƒbƒv 14پF ”»’è پi•Wڈ€ƒRƒ“ƒgƒچپ[ƒ‹‚ة‘خ‚·‚é‘ٹ‘خ’l‚ًژZڈoپj پ@Œ‹‰ت‚ح•Wڈ€ƒRƒ“ƒgƒچپ[ƒ‹‚ًٹîڈ€‚ئ‚µ‚ؤ‘ٹ‘خ’l‚ًژZڈo‚·‚éپB پ@پ@* ژZڈo•û–@
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
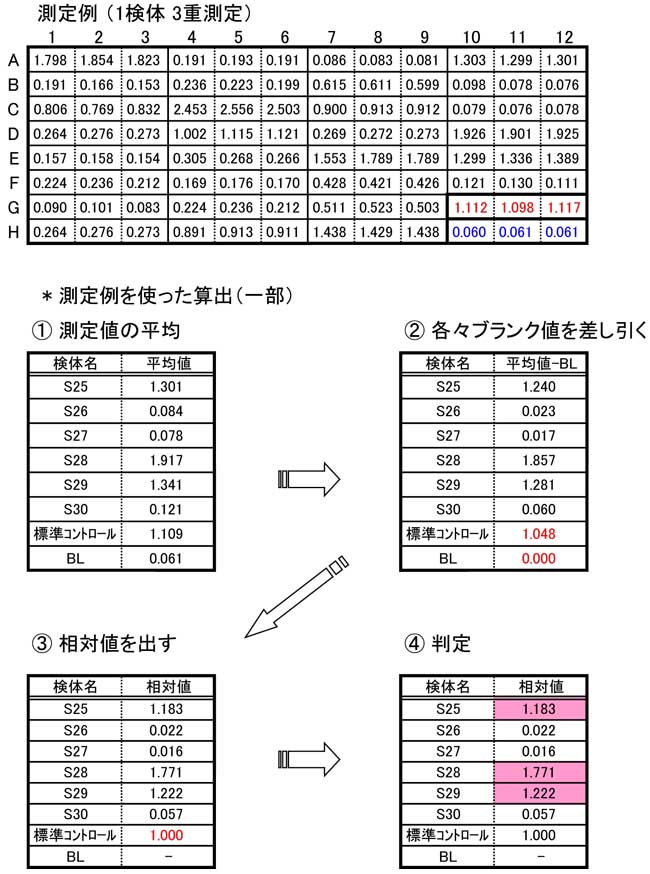
2) ‚±‚جƒfپ[ƒ^‚حژہچغ‚ج‘ھ’è—ل‚ًŒ³‚ةپCگà–¾‚ج‚½‚ك‚ة‰¼‘z“I‚ةچى‚èڈم‚°‚½‚à‚ج‚إ‚·پB |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
4-2.پ@‘€چىˆê——
پںپ@ژg—pژژ–ٍˆê——
پںپ@‘€چى‚ة•K—v‚بٹي‹ï—ق
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ƒtƒچپ[ƒVپ[ƒgپiKHVچR‘ج‘ھ’èپj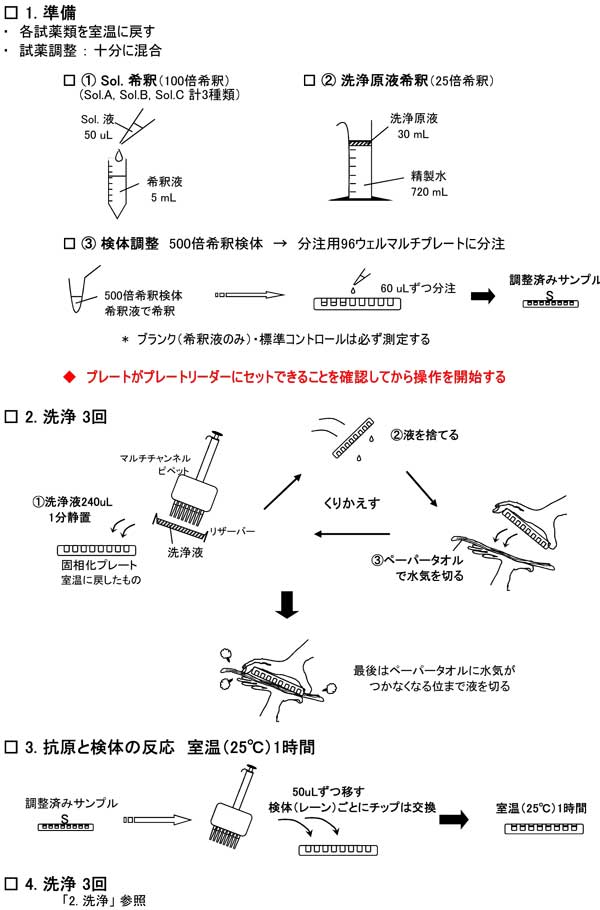
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Œں‘جƒŒƒCƒAƒEƒgƒVپ[ƒg‚ح‚±‚؟‚çپiExcelƒtƒ@ƒCƒ‹پj | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||
(c) Copyright 2001 National Research Institute of Aquaculture, Fisheries
Research and Education Agency All rights reserved. |
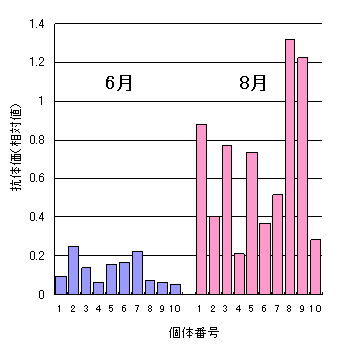 پ@ˆبڈم‚©‚ç–¾‚ç‚©‚ب‚و‚¤‚ةپC–{–@‚إ‚حپC‚ ‚é’lˆبڈم‚ب‚ç—zگ«پC‚»‚ê–¢–‚ب‚ç‰Aگ«پC‚ئ‚¢‚¤‚ح‚ء‚«‚肵‚½‹«ٹE‚ً’è‚ك‚邱‚ئ‚حŒ´—“I‚ة•s‰آ”\‚إ‚·پBگ}‚ً‚²——‚‚¾‚³‚¢پB‚±‚ê‚ح‰ك‹ژ‚ةKHV•a‚ھ”گ¶‚µ‚½‚ ‚éگ…Œn‚ةپCڈ¬‚³‚بگ¶‚¯âإ‚ًگف’u‚µ‚ؤپCڈt‚ةKHV‚ةٹ´گُ—ڑ—ً‚ج–³‚¢ƒRƒC‚ً“ü‚êپC6Œژپiگآپj‚ئ8Œژپiگشپj‚ة10”ِ‚¸‚آژو‚èڈم‚°‚ؤ–{–@‚ة‚و‚ء‚ؤچR‘ج‰؟‚ً‘ھ’肵‚½—ل‚ًŒآ‘ج‚²‚ئ‚ةژ¦‚µ‚½‚à‚ج‚إ‚·2)پB چR‘ج‰؟‚ح•Wڈ€ŒŒگ´‚ة‘خ‚·‚éٹeŒں‘ج‚ج‹zŒُ“x‚ج‘ٹ‘خ’l‚إ•\‚µ‚ؤ‚¢‚ـ‚·پBژژŒ±‚جٹشپC‘S‚ژ€–S‚ح‚ ‚è‚ـ‚¹‚ٌ‚إ‚µ‚½‚ھپC8Œژ‚جƒTƒ“ƒvƒ‹‚إ‚ح‘S‘ج“I‚ةچR‘ج‰؟‚ھڈمڈ¸‚µ‚ؤ‚¨‚èپCKHV‚ة–\کI‚³‚ꂽ‚±‚ئ‚ھژf‚¦‚ـ‚·پB‚µ‚©‚µپC‚à‚µƒTƒ“ƒvƒ‹‚ھ8Œژ‚جNo.7‚ج1Œآ‘ج‚µ‚©‚ب‚©‚ء‚½‚çپC‚±‚جŒآ‘ج‚ھٹ´گُ—ً‚ًژ‚آ‚©”غ‚©‚ًگ„’è‚·‚邱‚ئ‚ح•s‰آ”\‚إ‚·پB ‚±‚ج‚و‚¤‚ةپC–{–@‚حŒ´‘¥‚ئ‚µ‚ؤŒQ‚ة“K—p‚·‚ׂ«‚à‚ج‚إپC•،گ”‚جƒTƒ“ƒvƒ‹‚ج‘ھ’茋‰ت‚ًپCگ…‰·‚ب‚اٹآ‹«ڈًŒڈ‚âŒQ‚جژ”ˆç—ڑ—ًپC‚إ‚«‚ê‚خPCR‚جŒ‹‰ت‚ب‚ا‚ئ‚ئ‚à‚ة‘چچ‡“I‚ة”»’f‚·‚é•K—v‚ھ‚ ‚è‚ـ‚·پB‚½‚¾‚µپC1Œآ‘ج‚ج‚ف‚ج‘ھ’è‚إ‚àپC•Wڈ€ŒŒگ´‚ج‹zŒُ“x‚و‚èچ‚‚¢’l‚ًژ¦‚µ‚ؤ‚¢‚ê‚خ“–‘RKHV‚جٹ´گُ—ً‚ً‹^‚¤•K—v‚ھ‚ ‚è‚ـ‚·پB‚½‚¾‚µپCگو‚ةڈq‚ׂ½‚و‚¤‚ب—لٹO‚ھ‘¶چف‚·‚é‚ج‚إ’چˆس‚·‚é•K—v‚ھ‚ ‚è‚ـ‚·پB“ء‚ة‚»‚جŒQ‚ھCHV‚ةٹ´گُ‚µ‚ؤ‚¢‚éڈêچ‡‚حپC–{–@‚إKHV‚جٹ´گُ—ڑ—ً‚ًگ„’è‚·‚é‚ج‚حچ¢“ï‚إ‚·پB
پ@ˆبڈم‚©‚ç–¾‚ç‚©‚ب‚و‚¤‚ةپC–{–@‚إ‚حپC‚ ‚é’lˆبڈم‚ب‚ç—zگ«پC‚»‚ê–¢–‚ب‚ç‰Aگ«پC‚ئ‚¢‚¤‚ح‚ء‚«‚肵‚½‹«ٹE‚ً’è‚ك‚邱‚ئ‚حŒ´—“I‚ة•s‰آ”\‚إ‚·پBگ}‚ً‚²——‚‚¾‚³‚¢پB‚±‚ê‚ح‰ك‹ژ‚ةKHV•a‚ھ”گ¶‚µ‚½‚ ‚éگ…Œn‚ةپCڈ¬‚³‚بگ¶‚¯âإ‚ًگف’u‚µ‚ؤپCڈt‚ةKHV‚ةٹ´گُ—ڑ—ً‚ج–³‚¢ƒRƒC‚ً“ü‚êپC6Œژپiگآپj‚ئ8Œژپiگشپj‚ة10”ِ‚¸‚آژو‚èڈم‚°‚ؤ–{–@‚ة‚و‚ء‚ؤچR‘ج‰؟‚ً‘ھ’肵‚½—ل‚ًŒآ‘ج‚²‚ئ‚ةژ¦‚µ‚½‚à‚ج‚إ‚·2)پB چR‘ج‰؟‚ح•Wڈ€ŒŒگ´‚ة‘خ‚·‚éٹeŒں‘ج‚ج‹zŒُ“x‚ج‘ٹ‘خ’l‚إ•\‚µ‚ؤ‚¢‚ـ‚·پBژژŒ±‚جٹشپC‘S‚ژ€–S‚ح‚ ‚è‚ـ‚¹‚ٌ‚إ‚µ‚½‚ھپC8Œژ‚جƒTƒ“ƒvƒ‹‚إ‚ح‘S‘ج“I‚ةچR‘ج‰؟‚ھڈمڈ¸‚µ‚ؤ‚¨‚èپCKHV‚ة–\کI‚³‚ꂽ‚±‚ئ‚ھژf‚¦‚ـ‚·پB‚µ‚©‚µپC‚à‚µƒTƒ“ƒvƒ‹‚ھ8Œژ‚جNo.7‚ج1Œآ‘ج‚µ‚©‚ب‚©‚ء‚½‚çپC‚±‚جŒآ‘ج‚ھٹ´گُ—ً‚ًژ‚آ‚©”غ‚©‚ًگ„’è‚·‚邱‚ئ‚ح•s‰آ”\‚إ‚·پB ‚±‚ج‚و‚¤‚ةپC–{–@‚حŒ´‘¥‚ئ‚µ‚ؤŒQ‚ة“K—p‚·‚ׂ«‚à‚ج‚إپC•،گ”‚جƒTƒ“ƒvƒ‹‚ج‘ھ’茋‰ت‚ًپCگ…‰·‚ب‚اٹآ‹«ڈًŒڈ‚âŒQ‚جژ”ˆç—ڑ—ًپC‚إ‚«‚ê‚خPCR‚جŒ‹‰ت‚ب‚ا‚ئ‚ئ‚à‚ة‘چچ‡“I‚ة”»’f‚·‚é•K—v‚ھ‚ ‚è‚ـ‚·پB‚½‚¾‚µپC1Œآ‘ج‚ج‚ف‚ج‘ھ’è‚إ‚àپC•Wڈ€ŒŒگ´‚ج‹zŒُ“x‚و‚èچ‚‚¢’l‚ًژ¦‚µ‚ؤ‚¢‚ê‚خ“–‘RKHV‚جٹ´گُ—ً‚ً‹^‚¤•K—v‚ھ‚ ‚è‚ـ‚·پB‚½‚¾‚µپCگو‚ةڈq‚ׂ½‚و‚¤‚ب—لٹO‚ھ‘¶چف‚·‚é‚ج‚إ’چˆس‚·‚é•K—v‚ھ‚ ‚è‚ـ‚·پB“ء‚ة‚»‚جŒQ‚ھCHV‚ةٹ´گُ‚µ‚ؤ‚¢‚éڈêچ‡‚حپC–{–@‚إKHV‚جٹ´گُ—ڑ—ً‚ًگ„’è‚·‚é‚ج‚حچ¢“ï‚إ‚·پB